
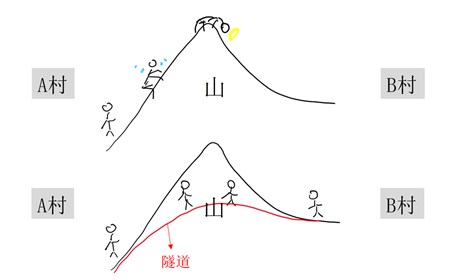
它給原本的反應找了一條更快更省力的“捷徑”
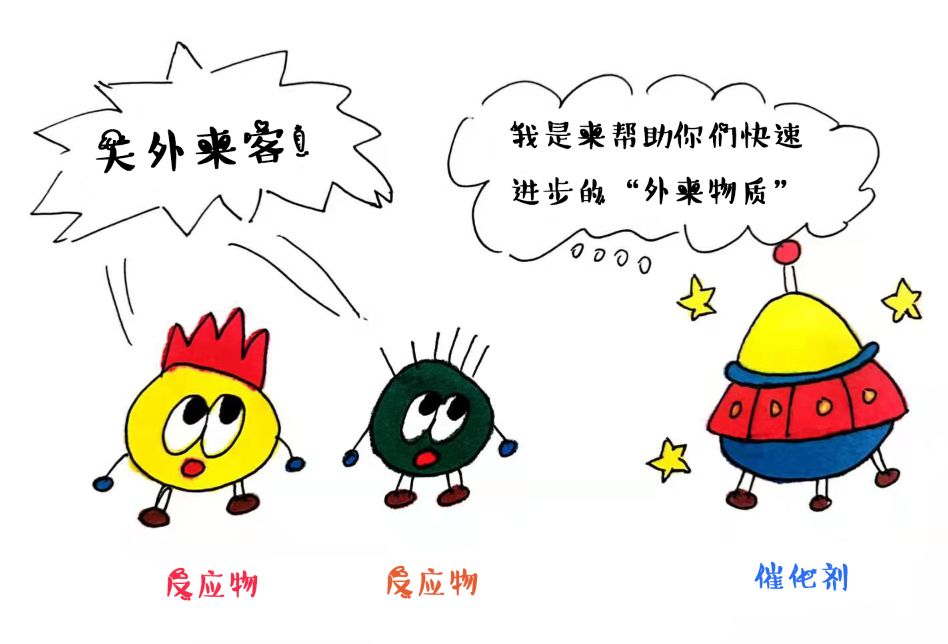
催化是指化學(xué)反應在外來(lái)物質(zhì)作用下反應速度加快的一種現象,這個(gè)“外來(lái)物質(zhì)”就被稱(chēng)作為催化劑啦!
其實(shí)啊~
人類(lèi)對催化技術(shù)的利用
已用幾千年的歷史啦~
可不是啥新鮮“玩意兒”
舉個(gè)栗子
釀酒釀醋的本質(zhì)
其實(shí)就是糧食中的淀粉
在微生物的作用下
轉變成酒精和醋酸
這一過(guò)程可就是典型的催化過(guò)程

而微生物就是催化劑本尊啦~
催化其實(shí)離我們一點(diǎn)也不遙遠
現在啊 人類(lèi)活動(dòng)中大約90%的
化學(xué)品生產(chǎn)過(guò)程與催化過(guò)程有關(guān)
可不僅僅如此哦~
生物的生命活動(dòng)過(guò)程也離不開(kāi)催化!
催化反應的門(mén)派駁雜
咱們今天就捋著(zhù)一種門(mén)派分類(lèi)來(lái)說(shuō)
那就是多相催化vs均相催化
均相催化說(shuō)白了
就是催化劑與反應物為同一相態(tài)
你曉得吧?
比如說(shuō)都是液相或氣相
如果不是
那就是多相催化嘍
均相催化一門(mén)具有
高活性、高選擇性的優(yōu)點(diǎn)
但是同時(shí)也不可避免
催化劑和產(chǎn)物難分離的缺點(diǎn)
目前的工業(yè)催化過(guò)程
絕大多數為多相催化過(guò)程
但是啊
多相催化一門(mén)事兒也比較多
催化劑得先把反應物“吸引”到表面
進(jìn)行反應,然后得到反應物后
嫌棄地把反應物“拋棄”掉